Important Questions For All Chapters – रसायन विज्ञान Class 11
परमाणु की संरचना
प्रश्न 1: इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन की खोज और उनके गुणों का वर्णन कीजिए।
उत्तर:
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन की खोज ने परमाणु संरचना के बारे में हमारी समझ को पूरी तरह से बदल दिया।
इलेक्ट्रॉन की खोज:
इलेक्ट्रॉन की खोज 1897 में जे.जे. थॉमसन द्वारा की गई थी। उन्होंने कैथोड किरण नलिका प्रयोग के माध्यम से यह दिखाया कि जब बहुत उच्च वोल्टेज लगाया जाता है, तो ऋणात्मक चार्ज वाले कण कैथोड से एनोड की ओर गति करते हैं। इन कणों को इलेक्ट्रॉन कहा गया। थॉमसन ने इन कणों के आवेश-से-मास अनुपात (e/m) को मापा, जो \(1.758820 × 10^{11} C/kg\) था।
प्रोटॉन की खोज:
प्रोटॉन की खोज अर्नेस्ट रदरफोर्ड ने 1919 में की थी। उन्होंने यह पाया कि जब α-कणों से एक पतली स्वर्ण पत्रक पर बमबारी की जाती है, तो अधिकांश कण बिना विचलन के पार हो जाते हैं, जबकि कुछ कण तीव्रता से विचलित हो जाते हैं। इससे यह निष्कर्ष निकला कि परमाणु के केंद्र में एक छोटा, घना और धनात्मक चार्ज वाला क्षेत्र होता है जिसे नाभिक कहा जाता है। नाभिक के भीतर मौजूद प्रोटॉन धनात्मक चार्ज वाले होते हैं और उनकी संख्या परमाणु संख्या के बराबर होती है।
न्यूट्रॉन की खोज:
न्यूट्रॉन की खोज 1932 में जेम्स चैडविक ने की थी। उन्होंने α-कणों के साथ बेरिलियम पर बमबारी करके न्यूट्रॉन को खोजा। न्यूट्रॉन विद्युत रूप से तटस्थ होते हैं और उनका द्रव्यमान प्रोटॉन के बराबर होता है। न्यूट्रॉन नाभिक के भीतर प्रोटॉन के साथ होते हैं और परमाणु के द्रव्यमान में योगदान करते हैं।
प्रश्न 2: रदरफोर्ड के परमाणु मॉडल और उसके मुख्य निष्कर्षों का वर्णन कीजिए।
उत्तर:
रदरफोर्ड ने अपने प्रसिद्ध α-कण प्रकीर्णन प्रयोग के माध्यम से परमाणु की संरचना का अध्ययन किया। उन्होंने पतली स्वर्ण पत्रक पर α-कणों की बमबारी की और उनके प्रकीर्णन का अध्ययन किया।
मुख्य निष्कर्ष:
परमाणु का अधिकांश भाग रिक्त होता है: अधिकांश α-कण बिना विचलन के स्वर्ण पत्रक से गुजर गए, जिससे यह स्पष्ट हुआ कि परमाणु के भीतर बहुत सारा खाली स्थान होता है।
परमाणु का नाभिक: कुछ α-कणों का तीव्र विचलन यह दर्शाता है कि परमाणु के केंद्र में एक घना, छोटा और धनात्मक चार्ज वाला क्षेत्र होता है जिसे नाभिक कहा जाता है। इस नाभिक में परमाणु का अधिकांश द्रव्यमान केंद्रित होता है।
नाभिकीय मॉडल: रदरफोर्ड के अनुसार, नाभिक के चारों ओर इलेक्ट्रॉन परिक्रमा करते हैं, जैसे सूर्य के चारों ओर ग्रह। इस मॉडल ने परमाणु के नाभिकीय मॉडल की नींव रखी।
प्रश्न 3: बोर के हाइड्रोजन परमाणु मॉडल की मुख्य विशेषताओं का वर्णन कीजिए।
उत्तर:
नील्स बोर ने 1913 में हाइड्रोजन परमाणु के लिए एक नया मॉडल प्रस्तुत किया, जिसमें उन्होंने प्लांक के क्वांटम सिद्धांत का उपयोग किया। बोहर के मॉडल की मुख्य विशेषताएं इस प्रकार हैं:
स्थिर कक्षाएं: इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं में परिक्रमा करते हैं। इन कक्षाओं को स्थिर अवस्था कहा जाता है और इनमें ऊर्जा स्थिर रहती है।
क्वांटम सिद्धांत: इलेक्ट्रॉन केवल तभी ऊर्जा का अवशोषण या उत्सर्जन करता है जब वह एक कक्षा से दूसरी कक्षा में स्थानांतरित होता है। ऊर्जा का यह परिवर्तन ΔE = hν के अनुसार होता है, जहां ν आवृत्ति है और h प्लांक का स्थिरांक।
कोणीय संवेग का क्वांटीकरण: इलेक्ट्रॉन का कोणीय संवेग \(\frac{nh}{2π}\) के अनुसार क्वांटीकृत होता है, जहां n एक पूर्णांक है।
ऊर्जा स्तर: हाइड्रोजन के इलेक्ट्रॉन के ऊर्जा स्तर को \(E_n = − \frac{2.18 × 10^{−18}}{n^2}\) जूल द्वारा व्यक्त किया जा सकता है। n की वृद्धि के साथ, कक्षा की त्रिज्या बढ़ती है और ऊर्जा का मान कम होता जाता है।
बोर के इस मॉडल ने हाइड्रोजन स्पेक्ट्रम की व्याख्या सफलतापूर्वक की और परमाणु संरचना की समझ को एक नया आयाम दिया।
प्रश्न 4: क्वांटम सिद्धांत के अनुसार इलेक्ट्रॉनों का दोहरी व्यवहार (द्वैत स्वभाव) क्या है? इसे समझाइए।
उत्तर:
क्वांटम सिद्धांत के अनुसार, इलेक्ट्रॉन न केवल कण की तरह व्यवहार करता है, बल्कि तरंग की तरह भी व्यवहार करता है। इसे द्वैत स्वभाव कहा जाता है।
तरंग-स्वभाव:
लुई डी ब्रोगली ने 1924 में प्रस्तावित किया कि जैसे प्रकाश की तरंगें कणों की तरह व्यवहार करती हैं, वैसे ही पदार्थ भी तरंगों की तरह व्यवहार कर सकता है। ब्रोगली ने यह सिद्ध किया कि किसी भी कण की तरंगदैर्ध्य λ = \(\frac{h}{mv}\) होती है, जहां h प्लांक का स्थिरांक है, m कण का द्रव्यमान है, और v उसकी वेग है।
कण-स्वभाव:
पारंपरिक रूप से, इलेक्ट्रॉनों को छोटे, स्थिर कण माना जाता था। लेकिन क्वांटम सिद्धांत के अनुसार, जब इलेक्ट्रॉनों की गति का अध्ययन किया गया, तो यह पाया गया कि वे तरंगों की तरह व्यवहार करते हैं। इस सिद्धांत ने रदरफोर्ड और बोहर के पारंपरिक परमाणु मॉडल में क्रांति ला दी और परमाणु संरचना को समझने के नए द्वार खोले।
महत्त्व:
इस द्वैत स्वभाव ने परमाणु की स्थिरता और स्पेक्ट्रा की व्याख्या को संभव बनाया और क्वांटम यांत्रिकी के विकास में एक महत्वपूर्ण भूमिका निभाई।
प्रश्न 5: थॉमसन के परमाणु मॉडल का वर्णन कीजिए और इसकी सीमाओं का उल्लेख कीजिए।
उत्तर:
जे.जे. थॉमसन ने 1898 में परमाणु की संरचना के बारे में एक मॉडल प्रस्तुत किया जिसे थॉमसन का “प्लम पुडिंग मॉडल” के नाम से जाना जाता है।
थॉमसन मॉडल की मुख्य विशेषताएं:
- गोलाकार आकार: थॉमसन ने प्रस्तावित किया कि परमाणु एक गोलाकार कण है जिसका त्रिज्या लगभग \(10^{-10}\)मीटर है।
- धनात्मक चार्ज का वितरण: इस मॉडल के अनुसार, परमाणु के अंदर धनात्मक चार्ज पूरे परमाणु में समान रूप से वितरित होता है।
- इलेक्ट्रॉनों की उपस्थिति: इलेक्ट्रॉन परमाणु के भीतर स्थिर रहते हैं और धनात्मक चार्ज के समुद्र में निहित होते हैं। यह इलेक्ट्रॉनों का स्थिर और धनात्मक चार्ज के बीच विद्युत स्थिरता बनाता है।
सीमाएं:
- परमाणु की स्थिरता: थॉमसन का मॉडल परमाणु की स्थिरता की सही व्याख्या नहीं कर सका। यह मॉडल यह नहीं समझा सका कि परमाणु कैसे स्थिर रहते हैं जबकि उनके अंदर इलेक्ट्रॉन और प्रोटॉन के बीच आकर्षण बल होता है।
- स्पेक्ट्रा की व्याख्या: यह मॉडल परमाणु स्पेक्ट्रा की व्याख्या करने में असमर्थ था, विशेष रूप से हाइड्रोजन के स्पेक्ट्रा की। थॉमसन का मॉडल यह समझाने में विफल रहा कि अलग-अलग तत्वों के अलग-अलग स्पेक्ट्रा क्यों होते हैं।
- रदरफोर्ड के प्रयोग: रदरफोर्ड के α-कण प्रकीर्णन प्रयोग ने यह स्पष्ट किया कि थॉमसन का मॉडल गलत था क्योंकि परमाणु के अधिकांश भाग में खाली स्थान होता है और एक छोटा, घना नाभिक होता है, जबकि थॉमसन ने परमाणु को एक ठोस वस्तु माना था।
प्रश्न 6: रेडफोर्ड के परमाणु मॉडल के साथ हुए प्रयोगात्मक अवलोकनों का विस्तारपूर्वक वर्णन कीजिए।
उत्तर:
रेडफोर्ड ने 1911 में α-कण प्रकीर्णन प्रयोग किया, जिसने परमाणु की संरचना को समझने में महत्वपूर्ण योगदान दिया। इस प्रयोग में α-कणों की एक पतली स्वर्ण पत्रक पर बमबारी की गई और उनके प्रकीर्णन का अध्ययन किया गया।
प्रयोगात्मक अवलोकन:
- अधिकांश कण बिना विचलन के पार हुए: यह देखा गया कि अधिकांश α-कण स्वर्ण पत्रक से सीधे गुजर गए। इसका अर्थ था कि परमाणु का अधिकांश भाग खाली होता है।
- कुछ कण छोटे कोणों से विचलित हुए: कुछ α-कणों का मार्ग बदल गया और वे छोटे कोणों से विचलित हुए। इससे यह निष्कर्ष निकला कि परमाणु में कहीं पर धनात्मक चार्ज अवश्य है जो इन कणों को विचलित कर रहा है।
- बहुत कम कण विपरीत दिशा में लौटे: एक बहुत छोटा भाग α-कणों का लगभग 180° के कोण पर वापस लौट आया। इसने संकेत दिया कि परमाणु के भीतर एक छोटा और घना नाभिक होता है जिसमें परमाणु का अधिकांश द्रव्यमान और धनात्मक चार्ज संकेंद्रित होता है।
प्रश्न 7: क्वांटम यांत्रिकी के विकास में प्लांक के क्वांटम सिद्धांत की क्या भूमिका रही? इसे उदाहरण सहित समझाइए।
उत्तर:
मैक्स प्लांक ने 1900 में क्वांटम सिद्धांत प्रस्तुत किया, जिसने भौतिकी में क्रांति ला दी और क्वांटम यांत्रिकी के विकास की नींव रखी।
प्लांक का क्वांटम सिद्धांत: प्लांक ने प्रस्तावित किया कि ऊर्जा का उत्सर्जन या अवशोषण छोटे-छोटे बंडलों में होता है जिन्हें “क्वांटा” कहा जाता है। यह ऊर्जा बंडल E = hν के रूप में व्यक्त किया जाता है, जहां h प्लांक का स्थिरांक है और ν विकिरण की आवृत्ति है। यह सिद्धांत भौतिकी के पारंपरिक सिद्धांतों से बिल्कुल अलग था, जो यह मानते थे कि ऊर्जा का उत्सर्जन निरंतर होता है।
क्वांटम सिद्धांत के उदाहरण:
- काला शरीर विकिरण: काला शरीर विकिरण की समस्या का समाधान प्लांक के क्वांटम सिद्धांत से हुआ। इसने यह समझाया कि किसी वस्तु का विकिरण उसकी सतह के तापमान पर निर्भर करता है और यह विकिरण छोटे-छोटे क्वांटा में होता है।
- प्रकाश विद्युत प्रभाव: प्लांक के क्वांटम सिद्धांत का उपयोग अल्बर्ट आइंस्टीन ने प्रकाश विद्युत प्रभाव को समझाने में किया। आइंस्टीन ने यह सिद्ध किया कि जब प्रकाश एक धातु की सतह पर गिरता है, तो वह अपनी ऊर्जा इलेक्ट्रॉनों को हस्तांतरित करता है, जिससे इलेक्ट्रॉन सतह से उत्सर्जित हो जाते हैं। यह प्रक्रिया केवल तभी होती है जब प्रकाश की आवृत्ति एक निश्चित सीमा से ऊपर हो, जिसे “थ्रेशोल्ड आवृत्ति” कहा जाता है।
महत्त्व: प्लांक का क्वांटम सिद्धांत क्वांटम यांत्रिकी के विकास में एक प्रमुख मील का पत्थर था। इसने न केवल परमाणु संरचना की गहरी समझ प्रदान की, बल्कि भौतिकी और रसायन विज्ञान में कई महत्वपूर्ण घटनाओं की व्याख्या भी की, जो क्लासिकल फिजिक्स से समझाई नहीं जा सकती थीं।
प्रश्न 8: हाइजेनबर्ग अनिश्चितता सिद्धांत का वर्णन कीजिए और इसकी महत्त्वपूर्णता पर चर्चा कीजिए।
उत्तर:
हाइजेनबर्ग अनिश्चितता सिद्धांत 1927 में जर्मन भौतिक विज्ञानी वर्नर हाइजेनबर्ग द्वारा प्रस्तुत किया गया था। यह सिद्धांत क्वांटम यांत्रिकी में एक बुनियादी अवधारणा है और यह बताता है कि किसी कण की स्थिति और गति दोनों को एक साथ सटीकता से मापना असंभव है।
हाइजेनबर्ग अनिश्चितता सिद्धांत: हाइजेनबर्ग के अनुसार, यदि हम किसी कण की स्थिति को जितनी अधिक सटीकता से मापते हैं, उतनी ही कम सटीकता से उसकी गति को मापा जा सकता है, और इसके विपरीत। इसे निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है:
जहाँ:
Δx स्थिति में अनिश्चितता है,
Δp संवेग (momentum) में अनिश्चितता है, और
h प्लांक का स्थिरांक है।
महत्त्व:
- परमाणु संरचना में: इस सिद्धांत ने इलेक्ट्रॉनों की स्थिति और गति की सटीकता के बारे में पारंपरिक दृष्टिकोण को चुनौती दी। इससे यह स्पष्ट हुआ कि हम केवल संभावना के आधार पर ही इलेक्ट्रॉनों की स्थिति के बारे में अनुमान लगा सकते हैं, जो कि इलेक्ट्रॉनिक संरचना के क्वांटम यांत्रिकी मॉडल का मूल आधार है।
- मापन की सीमा: हाइजेनबर्ग अनिश्चितता सिद्धांत ने मापन के कार्य में मौलिक सीमाओं को स्पष्ट किया और यह दिखाया कि क्वांटम स्तर पर मापन की प्रक्रिया ही मापी जा रही वस्तु को प्रभावित करती है।
- क्लासिकल भौतिकी की सीमाएँ: इस सिद्धांत ने यह भी दिखाया कि क्लासिकल भौतिकी के सिद्धांत, जो कणों की स्थिति और गति दोनों को सटीक रूप से मापने की अनुमति देते थे, परमाणु और उप-परमाणु स्तर पर काम नहीं करते हैं।
प्रश्न 9: बोर के परमाणु मॉडल की सीमाओं का वर्णन कीजिए।
उत्तर:
हालांकि बोर का परमाणु मॉडल हाइड्रोजन जैसे सरल परमाणुओं के लिए बहुत सफल साबित हुआ, लेकिन यह कुछ महत्वपूर्ण बिंदुओं पर विफल रहा।
मुख्य सीमाएँ:
- स्पेक्ट्रा की अधिक जटिलता: बोर का मॉडल केवल हाइड्रोजन के सरल स्पेक्ट्रम को ही समझा सका। यह मॉडल दोहरे स्पेक्ट्रम लाइनों (डबल्ट) और मल्टीप्लेट स्पेक्ट्रा जैसी जटिलताओं की व्याख्या करने में असमर्थ था। यह अन्य तत्वों, जैसे हीलियम, के स्पेक्ट्रम की भी सही व्याख्या नहीं कर सका।
- ज़ीमैन और स्टार्क प्रभाव: बोर का मॉडल ज़ीमैन प्रभाव (चुंबकीय क्षेत्र में स्पेक्ट्रम की लाइनों का विभाजन) और स्टार्क प्रभाव (विद्युत क्षेत्र में स्पेक्ट्रम की लाइनों का विभाजन) को स्पष्ट नहीं कर सका।
- रासायनिक बंधन की व्याख्या: बोर का मॉडल यह नहीं समझा सका कि परमाणु एक साथ कैसे बंधते हैं और अणु बनाते हैं। यह इलेक्ट्रॉनिक संरचना के माध्यम से रासायनिक गुणों की व्याख्या करने में विफल रहा।
- क्वांटम यांत्रिकी के सिद्धांत: बोर का मॉडल पूरी तरह से क्लासिकल यांत्रिकी पर आधारित था, जो क्वांटम यांत्रिकी के सिद्धांतों के साथ असंगत था। यह मॉडल अनिश्चितता सिद्धांत और इलेक्ट्रॉन के तरंग-कण द्वैत स्वभाव को ध्यान में नहीं रखता।
प्रश्न 10: परमाणु के रदरफोर्ड मॉडल में इलेक्ट्रॉनों की कक्षाओं की स्थिरता की समस्या का वर्णन कीजिए।
उत्तर:
रदरफोर्ड के परमाणु मॉडल के अनुसार, इलेक्ट्रॉन नाभिक के चारों ओर एक निश्चित कक्षा में परिक्रमा करते हैं। हालांकि, इस मॉडल के साथ कुछ समस्याएँ भी थीं, विशेषकर इलेक्ट्रॉनों की कक्षाओं की स्थिरता के संदर्भ में।
समस्याएँ:
- विद्युत चुंबकीय विकिरण: रदरफोर्ड के मॉडल के अनुसार, इलेक्ट्रॉन लगातार एक वक्र पथ में गति कर रहे हैं, जिससे उन्हें त्वरित आवेशित कण माना जाता है। विद्युत चुंबकीय सिद्धांत के अनुसार, त्वरित आवेशित कण विकिरण (ऊर्जा) उत्सर्जित करते हैं। इस ऊर्जा के उत्सर्जन के कारण इलेक्ट्रॉन की गति धीमी हो जाएगी, और यह अंततः नाभिक में गिर जाएगा। लेकिन ऐसा वास्तविकता में नहीं होता।
- परमाणु की अस्थिरता: यदि रदरफोर्ड के मॉडल के अनुसार इलेक्ट्रॉन विकिरण करता है, तो इसे कुछ ही समय में नाभिक में गिर जाना चाहिए, जिससे परमाणु अस्थिर हो जाए। लेकिन परमाणु स्थिर होते हैं और यह सिद्धांत इस स्थिरता की व्याख्या नहीं कर सका।
- स्पेक्ट्रम की व्याख्या: रदरफोर्ड का मॉडल हाइड्रोजन और अन्य तत्वों के स्पेक्ट्रम की व्याख्या करने में भी विफल रहा। यह स्पेक्ट्रम की रेखाओं को समझाने के लिए आवश्यक ऊर्जा स्तरों की अवधारणा नहीं प्रस्तुत कर सका।
प्रश्न 11: हाइड्रोजन परमाणु के लिए स्पेक्ट्रम की श्रृंखलाओं का वर्णन कीजिए और उनकी महत्त्वता पर चर्चा कीजिए।
उत्तर:
हाइड्रोजन के परमाणु स्पेक्ट्रम में कई श्रृंखलाएँ पाई जाती हैं, जिनमें से प्रत्येक एक विशेष ऊर्जा स्तर के संक्रमण का प्रतिनिधित्व करती है।
स्पेक्ट्रम की प्रमुख श्रृंखलाएँ:
- लाइमैन श्रृंखला: जब इलेक्ट्रॉन उच्च ऊर्जा स्तर (n > 1) से n = 1 ऊर्जा स्तर पर गिरता है, तो विकिरण पराबैंगनी (यूवी) क्षेत्र में होता है। इसे लाइमैन श्रृंखला कहा जाता है।
- बाल्मर श्रृंखला: जब इलेक्ट्रॉन उच्च ऊर्जा स्तर (n > 2) से n = 2 ऊर्जा स्तर पर गिरता है, तो विकिरण दृश्य प्रकाश के क्षेत्र में होता है। इस श्रृंखला में स्पेक्ट्रम की लाइनों का दृश्य में आना इसे सबसे महत्वपूर्ण बनाता है।
- पासचेन श्रृंखला: जब इलेक्ट्रॉन उच्च ऊर्जा स्तर (n > 3) से n = 3 ऊर्जा स्तर पर गिरता है, तो विकिरण अवरक्त (IR) क्षेत्र में होता है। इसे पासचेन श्रृंखला कहा जाता है।
- ब्रैकेट और फुंड श्रृंखला: ये श्रृंखलाएँ भी अवरक्त क्षेत्र में होती हैं, जहाँ इलेक्ट्रॉन n = 4 और n=5n = 5n = 5 ऊर्जा स्तरों पर गिरते हैं, क्रमशः।
महत्त्व:
- परमाणु संरचना की समझ: हाइड्रोजन स्पेक्ट्रम की इन श्रृंखलाओं ने परमाणु संरचना की गहरी समझ प्रदान की। यह साबित किया कि परमाणु के अंदर ऊर्जा स्तर होते हैं और इलेक्ट्रॉन इन स्तरों के बीच संक्रमण करते हैं।
- रासायनिक विश्लेषण: स्पेक्ट्रम की इन श्रृंखलाओं का उपयोग रासायनिक विश्लेषण में तत्वों की पहचान करने के लिए किया जाता है। प्रत्येक तत्व का विशिष्ट स्पेक्ट्रम होता है, जो उसे अन्य तत्वों से अलग करता है।
- बोहर मॉडल की पुष्टि: इन स्पेक्ट्रम श्रृंखलाओं ने बोहर के परमाणु मॉडल की पुष्टि की और यह सिद्ध किया कि इलेक्ट्रॉन निश्चित ऊर्जा स्तरों में परिक्रमा करते हैं।

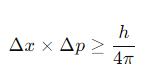
Leave a Reply